外源钙缓解花生低温胁迫:3个品种发芽率与酶活性分析
低温和外源钙胁迫对不同花生种子萌发和幼苗生长的影响
摘要:为了探讨低温和外源钙对花生不同品种种子萌发和幼苗生长的影响,以6℃为低温胁迫,采用不同浓度(0、10、30、50mmol/L)的CaCl2处理‘鲁花11号’‘晋花3号’‘吉花3号’,研究低温和外源钙胁迫对花生不同品种种子萌发特性和幼苗生长的影响。结果表明,低温胁迫下,‘吉花3号’‘晋花3号’‘鲁花11号’的发芽率均显著低于CK,分别为66.67%、65.33%和59.33%;发芽势、发芽指数和活力指数也显著低于对照。施外源钙后,‘吉花3号’‘晋花3号’‘鲁花11号’的种子发芽率可以提高到79.67%、78.67%和75.33%,发芽势、发芽指数和活力指数也显著上升。同时,在低温和外源钙的作用下,所有品种幼苗的SOD和POD酶活性、脯氨酸的含量与钙离子浓度呈正相关,但丙二醛含量则先增后减。花生不同品种对低温和外源钙的响应有较大差异,但低浓度的外源钙均可以促进3个品种对低温逆境的抵抗。这表明外源钙可有效缓解低温胁迫,为花生主产区的生产栽培提供借鉴。
花生(ArachishypogaeaL.)不仅是我国主要的经济和油料作物,也是我国优质食用蛋白和食用油的来源,具有重要的营养价值和经济价值[1-3]。我国花生的常年种植面积大约稳定在467万hm2,北方地区所占比例较大,仅黑龙江的种植面积已达到13.3万hm2,且呈现出种植比例稳步上升的趋势[1,4]。近年来,倒春寒已成为影响我国农业种植与生产的季节性气象灾害[1,5]。其带来的低温冻害不仅抑制了作物种子的发芽,降低种子的活力,还影响幼苗的生长发育[2],导致出苗缓慢,幼苗一致性较差;推迟作物的物候期,甚至种子腐烂或幼苗被冻死,造成大面积减产或绝收,最终影响我国农业的健康、可持续发展[1]。
钙是植物生长发育所必需的大量元素之一,具有维持细胞膜和膜结合蛋白等结构稳定,调节无机离子运输之功能[6-7]。钙不仅是植物细胞壁的成分,而且可以调节多种酶的活性,影响植物的生长发育[7]。钙离子作为胞内第二信使,在响应外界胁迫和调控胞内多种生理生化代谢中起到重要的作用[6,8]。研究表明,外源钙可以提高香黄檀[9]、花生[10]、青冈栎[11]、玉米[12]等植物对低温、酸雨、干旱、盐害等逆境胁迫的耐受性,减轻逆境胁迫对植物的伤害,促进植物种子的萌发和植株的生长发育。目前,相关研究主要集中在微量元素、密植、酸雨、贮藏方式等因素对花生种子萌发和幼苗生长的影响[13-16],而在外源钙和低温方面尚未见报道。基于此,研究外源钙和低温胁迫对花生种子萌发和幼苗生长的影响,以期为花生的生产与栽培提供相应理论支持。
1材料与方法
1.1材料
供试的花生品种为’鲁花11号’‘晋花3号’和‘吉花3号’。选取籽粒饱满、大小一致的花生种子作材料。
1.2方法

CaCl2的浓度水平为0、10、30、50mmol/L,温度为6℃,以25℃为对照。试验共设计5个处理(表1)。分别对‘鲁花11号’‘晋花3号’和‘吉花3号’的种子进行筛选,将挑选出来的种子放在培养盘中浸泡,置于25℃的恒温培养箱吸水24h。随后,根据表1组合,将吸水后的种子整齐摆放在铺有2层滤纸的培养盘,加入适量的CaCl2溶液(对照组加入等量的蒸馏水),用保鲜膜覆盖培养盘,放在相应温度的恒温培养箱中试验。每个处理重复3次,每次100粒种子。每间隔24h,统计每1d花生种子的发芽情况。试验结束后,测定每个处理幼苗SOD、POD等抗氧化酶的活性,以及丙二醛和脯氨酸的含量。
1.3指标测定
试验结束后,计算或测定每个处理的发芽率、发芽势、发芽指数、活力指数、胚根长等指标[1,13]。同时,利用氮蓝四唑光还原法测定SOD的活性,愈创木酚法测定POD活性[2,10];用硫代巴比妥酸显色法测定MDA的含量[17];脯氨酸检测参照常博文等[1]的方法。利用Mi-crosoftExcel2016对数据进行统计与整理,用SPSS2.0软件进行处理与分析。
2结果与分析
2.1低温和外源钙胁迫对花生种子发芽率和发芽势的影响
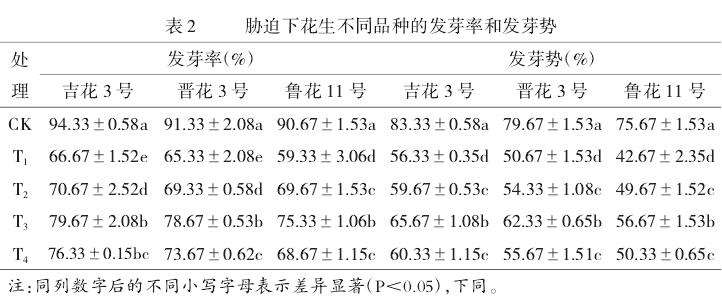
由表2可知,不同浓度的外源钙可以不同程度地促进花生种子的发芽率和发芽势。在低温(6℃)处理下,‘吉花3号’‘晋花3号’‘鲁花11号’的发芽率分别为66.67%、65.33%和59.33%,发芽势分别为56.33%、50.67%和42.67%,均显著低于CK。施外源钙后,随着钙浓度的提高,花生不同品种的发芽率和发芽势呈现出先增加后降低的趋势。T3处理时,3个品种的发芽率和发芽势均达到最高,‘吉花3号’分别为79.67%和65.67%,‘晋花3号’分别为78.67%和62.33%,‘鲁花11号’分别为75.33%和56.67%,分别较无外源钙的T1处理增加了13.00、9.34、13.34、11.66、16.00和14.00个百分点。当外源钙浓度为50mmol/L时,花生的发芽率和发芽势显著高于6℃低温处理,但却显著低于T3处理。表明较高浓度的外源钙可能会抑制种子的萌发。
2.2低温和外源钙胁迫对花生种子发芽指数和活力指数的影响
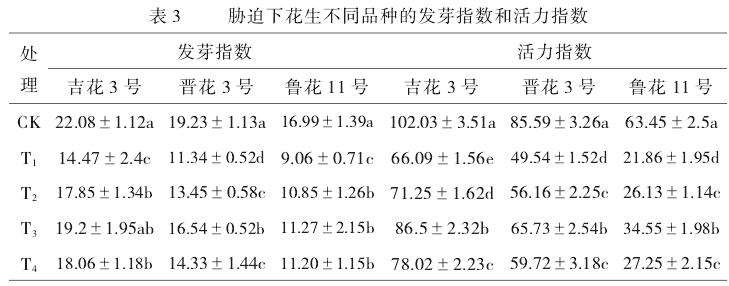
由表3可知,低温和外源钙对花生发芽指数和活力指数产生了显著影响,但不同品种有较大的差异。6℃处理后,与常温的CK相比,3个品种的发芽指数均显著下降,活力指数也表现出同样的趋势。同时,外源钙极大提高花生对低温的耐受性,各处理的发芽指数和活力指数均显著提高。钙浓度为10mmol/L时,与T1处理相比较,‘吉花3号’‘晋花3号’‘鲁花11号’的发芽指数分别增加了3.38、2.11和1.79,活力指数分别增加了5.16、6.62和4.27。当外源钙浓度为30mmol/L时,各处理的发芽指数和活力指数达到最高。随着钙浓度的进一步提升,发芽指数和活力指数有所下降,但仍然显著高于T1处理。
2.3低温和外源钙胁迫对花生幼苗抗氧化酶的影响
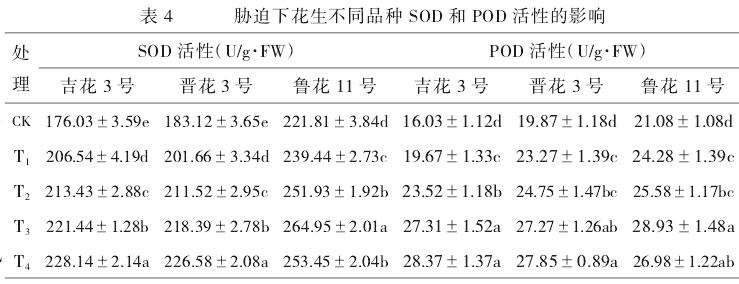
超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物重要的抗氧化酶。在逆境胁迫下,植物通过提高抗氧化酶的活性,清除氧自由基等有害次生代谢产物。在低温和外源钙的作用下,花生不同品种的SOD和POD活性有显著的变化(表4)。6℃低温处理下,2种酶的活性显著高于常温的CK处理。通过添加外源钙后,‘吉花3号’‘晋花3号’幼苗的抗氧化酶活性与钙浓度呈正相关;‘鲁花11号’则先增加后降低,但均高于T1处理。当钙的浓度为50mmol/L,即T4处理时,‘吉花3号’‘晋花3号’SOD活性分别为228.14、226.58U/g·FW,达最高;POD的活性分别为28.37、27.85U/g·FW,达最高。但‘鲁花11号’的SOD和POD酶活性在钙的浓度为30mmol/L,即T3处理时,分别为264.95U/g,FW和28.93U/g·FW,达最高。同时,在CK处理下,‘鲁花11号’SOD和POD活性相对高于另外2个品种;而在高浓度钙和低温处理下,‘鲁花11号’SOD和POD活性呈现下降。这表明该品种的抗逆性相对另外2个品种较差。
2.4低温和外源钙胁迫对花生幼苗MDA和脯氨酸的影响
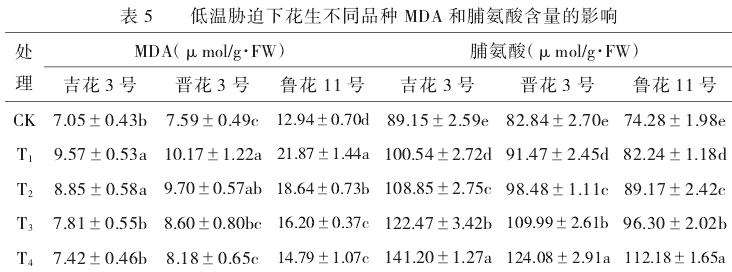
低温胁迫导致3个供试品种幼苗的丙二醛和脯氨酸的含量升高(表5)。添加外源钙后,幼苗的脯氨酸含量增加,提高了幼苗的耐寒性;丙二醛的含量降低,缓解了胁迫下的伤害。6℃低温处理下,‘吉花3号’‘晋花3号’‘鲁花11号’幼苗的MDA含量显著升高,较CK分别增加了2.52、2.58和8.93μmol/g·FW。添加外源钙后,幼苗的MDA含量逐渐降低。当外源钙的浓度为50mmol/L,3个品种的MDA含量分别降到了7.42、8.18和14.79μmol/g·FW,但均比常温处理的高。同时,低温导致3个品种幼苗的脯氨酸含量增加,其中,‘吉花3号’上升最大,增加了11.39μmol/g·FW。外源钙处理后,随着钙浓度的升高,各品种的脯氨酸含量也显著增加。当钙的浓度为50mmol/L,‘吉花3号’‘晋花3号’‘鲁花11号’的丙二醛含量达到最大,分别为141.20、124.08和112.18μmol/g·FW,比T1处理分别增加了40.66、32.61和29.94μmol/g·FW。
3讨论
低温胁迫是植物在生长发育过程中经常遭遇的非生物胁迫之一。该胁迫不仅影响植物的种子萌发和生长发育,还成为诸多野生植物地理分布的限制因子[18]。植物生活史中,种子的形成和萌发是重要而关键的阶段之一。在萌发过程中,种子对外界低温等逆境胁迫较为敏感,抵抗能力相对较差,但不同植物或同一植物的不同品种对低温的耐受性有较大的差异[2,5]。本研究结果表明,在T1处理下,‘吉花3号’‘晋花3号’‘鲁花11号’等3个花生品种的发芽率分别降低了27.63%、26.00%和31.34%,发芽势、发芽指数和活力指数也呈现类似的结果。这和常博文等[1]、钟鹏等[2]的研究结果类似。同时,植物抵抗各种逆境胁迫能力的强弱与抗氧化酶系统的活性有一定的相关性[18]。
低温胁迫时,为应对不利的环境,植物代谢会发生变化,产生更多的脯氨酸以提高细胞的冰点,并合成SOD和POD等抗氧化酶,以清除氧自由基等有害代谢物,提高植物的耐寒性[18]。T1处理下,本试验3个供试的花生品种的SOD和POD酶活性显著升高,脯氨酸和丙二醛的含量也显著上升。然而,3个品种的SOD和POD酶活性升高的程度不同,‘吉花3号’上升幅度最大,分别为30.51和3.64U/g·FW;‘鲁花11号’上升幅度最小,分别为17.63和3.20U/g·FW。脯氨酸含量也有类似的变化。这说明‘吉花3号’的耐寒性要强于‘鲁花11号’[1,18]。
钙和钙调素参与胁迫信号的感受、传递、响应与表达,因而钙离子可提高植物对逆境胁迫的耐受性,在植物生长发育中起了重要的作用[19]。然而,低浓度的钙离子可以有效促进植物的生长发育,但高浓度的钙离子则会起到抑制作用,降低了产量和品质,给农林业的生产带来严重影响[7]。邓平等[11]研究表明,青冈栎种子的发芽率、发芽势、发芽指数等萌发特性与外源钙浓度呈负相关。吕朝燕等[7]研究紫花苜蓿也得到类似的结论。
从本试验可知,添加外源钙可以有效缓解低温胁迫,提高种子的萌发特性和幼苗的耐寒性。随着钙浓度的逐渐提高,‘吉花3号’‘晋花3号’‘鲁花11号’的发芽率、发芽势、发芽指数和活力指数表现出先增加而后下降的趋势。这与上述研究人员的结果相一致。而在幼苗生理指标上,‘吉花3号’‘晋花3号’幼苗的SOD和POD酶活性与外源钙的浓度呈正相关,‘鲁花11号’则先增后降;3个品种幼苗的MDA含量随着钙浓度增高而逐渐降低,脯氨酸含量则相反,但各个品种的增加或降低的幅度差异较大。低温胁迫下,3个花生品种对钙浓度的响应出现种子萌发特性低促高抑和幼苗生理变化的现象。
这可能和品种的耐受能力高低有一定的关系,而且钙浓度增加,易于造成种子所处的环境水势降低,致使种子吸水困难,进而抑制呼吸作用[7,19]。概言之,花生不同品种对低温和外源钙的响应有较大差异,但低浓度的外源钙可以促进不同品种对低温逆境的抵抗。因此,初步认为在花生的种植过程中,可以施用低浓度(如10mmol/L)的外源钙,以实现保产提质的生产目的。
